Forskning

Hygiene i hvitfiskmottak
Nofima-forskere har undersøkt hvilke bakterier som finnes på prosessutstyr i hvitfiskmottak og om disse bakteriene kan redusere produktkvaliteten.
Hvitfisksesongen kan være intens og preget av kompromisser. Et eksempel på et dilemma flere fiskemottak kommer opp i, er kravet til tilstrekkelig tid til renhold opp mot kravet til en rask omsetning av fisken som landes – begge viktige for å oppnå best mulig kvalitet på produktet.

Det har vært reist spørsmål om mangelfullt renhold kan redusere kvaliteten til produktene og skrekkbilder av den såkalte Gulsleipa (markant gult bakteriebelegg) har versert i. Til nå har man visst lite om hvilke bakterier som finnes på prosessutstyr i hvitfiskmottak og om de kan redusere produktkvaliteten.
Forringelsesbakterier
Vi har undersøkt hvilke bakterier som finnes på prosessutstyr i to fiskemottak i slutten av sesongen. Vi har også sett på om det kan finnes metoder som vil gjøre det lettere å vurdere om renholdet er godt nok.
Holdbarhetstiden til fisk avgjøres av antall og type bakterier på råvaren i utgangspunktet, samt smitte og vekst av bakterier på råvarer og produkt under prosess og lagring fram til konsum. Når man analyserer helt fersk, prosessert fisk finner man en rekke ulike bakterier. Disse bakteriene stammer fra råvaren (levende fisk), men også fra miljøet som råvaren har blitt eksponert for.
Det er ofte bare en liten fraksjon av de bakteriene som er på fisken rett etter prosessering som etter hvert vokser opp på produktet og bare en fraksjon av dem igjen som endrer produktets smak og lukt. Derfor gir ikke kimtall ved produksjonsdag nødvendigvis et godt svar på hvor lang holdbarhet produktet har. På samme måte vil ikke kimtall i produksjonsmiljøet gi et direkte mål på fare for smitte med forringelsesbakterier, med mindre man har informasjon om hvilke bakterier dette totalkimet består av.
Det er godt kjent hvilke bakterier som kan forkorte holdbarheten til fersk hvitfisk, avhengig av pakkemetode. Tre bakterier som ofte blir nevnt i denne sammenhengen er Photobacterium, Shewanella og Pseudomonas (1-3). For saltfisk og klippfisk vil forringelsesfloraen være dominert av saltelskende bakterier, særlig bakterien Psychrobacter (4). Det er derfor ekstra interessant å se om akkurat disse bakteriene finnes i produksjonsmiljøet. Mer kunnskap om dette vil si noe om renholdet i dag er godt nok til at man oppnår den mikrobiologiske kvaliteten man ønsker.
Gjennomføring
Vi besøkte to fiskemottak i slutten av sesongen for å finne ut mer om hvilke bakterier som kan finnes i bakteriebelegg. Vårt utgangspunkt var å finne ut om dette belegget består av bakterier som kan redusere holdbarheten til fersk fisk og klippfisk/saltfisk. De to mottakene vi besøkte produserte sløyd saltfisk og fersk fisk.
Vi tok prøver gjennom hele linja fra brygga til modningsrom. Det ble tatt prøver for bakterieanalyser fra punkter som er i kontakt med råvare/produkt og særlig punkter med synlig smuss. Bakteriesamfunnet i prøver med synlig, gult belegg (totalt 10 prøver) ble undersøkt ved DNA-sekvensering. Vi brukte flere metoder for å måle hygiene: Visuell kontroll, kimtall, ATP-måling og proteinmåling.
Bakteriesamfunn i belegg
Felles for begge mottakene var at transportører ofte hadde synlig belegg, selv etter renhold. I den ene bedriften var det tørt og flere dager siden produksjon, men allikevel høye bakterietall.
Som man ser av Figur 1 var det komplekse bakteriesamfunn i alle prøvene. Mange av bakteriene man fant er lite beskrevet i litteraturen og er derfor angitt med samlebetegnelser (slik som for eksempel Gammaproteobacteria).
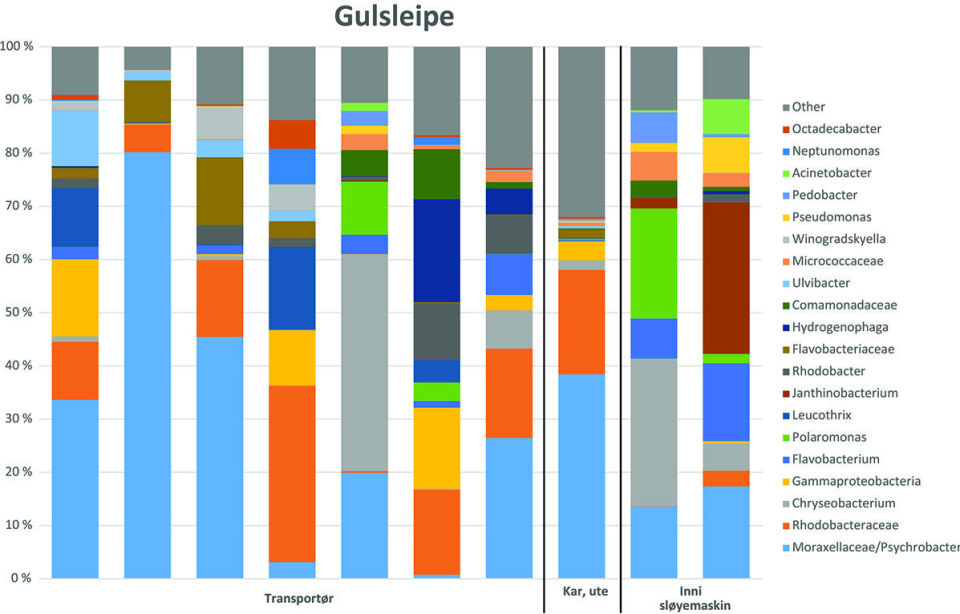
Figur 2 viser bakteriesamfunnet om man ser alle prøvene under ett. Ikke så overraskende var det gule belegget dominert av mikroorganismer man vet at trives i biofilm i marine miljøer (5):
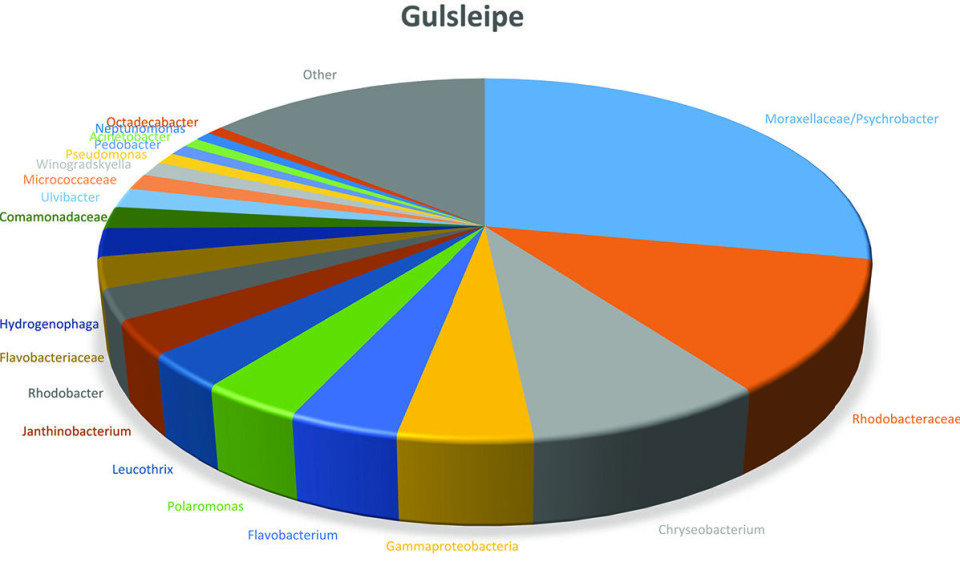
De vanligste bakteriegruppene
Moraxellaceae ble funnet i alle prøvene. Denne gruppen var dominert av Psychrobacter, en salt- og kuldeelskende bakterie som er regnet som den viktigste forringelsesbakterien for saltfisk/klippfisk under utvanningsprosess og lagring etter utvanning (4). Siden Psychrobacter finnes i sjø og på levende fisk har det tidligere vært antatt at viktigste smittekilde har vært råvaren selv (4, 6)og man har trodd at det er vanskelig å øke holdbarheten til utvannet saltfisk. De nivåene av Psychrobacter vi fant her kan tyde på at produksjonsmiljøet bidrar til å øke antallet på produktet gjennom kontakt mellom råvarer og prosessutstyr.
Rhodobacteriaceae ble funnet i alle prøver og var relativt dominerende i noen prøver. Denne gruppen omfattet blant annet Roseobacter-gruppen, som er kjent som pionerer i biofilmdannelse på overflater i sjømiljø (7). Det er ikke beskrevet at denne bakterien påvirker kvalitet til fiskeprodukter.
Flavobacteriaceae ble funnet i alle prøver og dominerte i enkelte. Viktige representanter for denne type bakterier var Chryseobacterium og Flavobacterium. Disse bakteriene er vanlige i marine omgivelser og i levende fisk og har blitt isolert fra utstyr i prosessering av fisk. Det er også vist at de ofte foretrekker å vokse på overflater framfor i væsker (6-9). Selv om denne type bakterier ofte kan vokse opp på fiskeprodukter under lagring, er det usikkert hvilken betydning de har for spisekvalitet og holdbarhet.
Gammaproteobacteria grupperer en rekke ulike bakterier. Nærmere analyser viste dominans av bakterier som var beslektet med bakterien Granulosicoccus. Dette er en marin bakterie som ikke er knyttet til endring i holdbarhet.
Betydning av belegg for kvalitet og holdbarhet
De bakteriene som oftest nevnes i forbindelse forringelse av fersk hvitfisk (Shewanella, Pseudomonas, Photobacterium (1-3)) utgjorde kun en liten del av belegget, men var allikevel oppe i nivåer over det man antar vil være med å forringe kvaliteten (>100 cfu/cm2).
Vi analyserte ikke produkter i denne undersøkelsen, men en sammenlikning med andre studier kan indirekte gi noen svar på hvor stor betydning bakterier i produksjonsmiljøet kan ha på kvalitet av fersk fisk. Vi har tidligere undersøkt sammenhengen mellom forekomst av forringelsesbakterier på slakte- og fileteringslinjer og mikrobiologisk holdbarhet av laks. Selv om bedriftene hadde godt, daglig renhold fant vi at bakterietallet ofte var 10 -100 ganger høyere etter 10 dager lagring på is for fileter som hadde blitt produsert industrielt enn fileter som var håndslaktet og –filetert (9). Nivået av forringelsesbakterier i det gule belegget i hvitfiskbedriftene varierte, men var likt eller høyere enn det man fant på overflatene under produksjon av laks.
Bedre renhold øker holdbarheten
Konklusjonen er at bedre renhold vil bidra til å forbedre mikrobiologisk holdbarhet hos fersk og saltet hvitfisk gjennom å redusere antall forringelsesbakterier på overflatene.

For saltfisk og klippfisk er det også rimelig å anta at man vil kunne øke mikrobiologisk kvalitet til sluttproduktet om råvarene ikke kommer i kontakt med bakteriebelegg. Dette fordi belegget inneholder høye antall bakterier av den viktigste holdbarhetsreduserende bakterien for denne type produkter, Psychrobacter. Det vil være nødvendig med flere undersøkelser for å kunne bekrefte dette, og det vil være interessant å se på hvordan ulike nivåer og typer Psychrobacter i råvaren påvirker endelig spisekvalitet.
Hva er beste metode for å overvåke hygiene?
Undersøkelsen tydet på man kan bedre holdbarheten ved bedre produksjonshygiene. For å kunne overvåke renholdsprosessen er det behov for metoder som gir raske svar på om renholdet er godt nok.
Det finnes flere metoder for å måle hvor ren en overflate er. Den optimale metoden gir et raskt svar på om en overflate er ren nok til produksjonen kan starte uten at råvarekvaliteten er truet. Smuss inneholder ikke alltid bakterier, men kan være en grobunn for bakterier i fuktige betingelser. Et alternativ eller supplement til ordinære renholdsprøver basert på bakterietall (kimtall) er derfor å måle smuss. Resultatene våre viste at:
-
Kimtallsanalyser er generelt den mest følsomme metoden for å måle hygiene. Unntaksvis fant vi områder som så skitne ut, men som hadde lave bakterietall. Dette gjaldt særlig prøver som var tatt utendørs. Hvis man ønsker å fange opp bakterier som kan være problematiske for kvaliteten, må man særlig se etter kulde-elskende bakterier. Det er derfor viktig å velge metodikk for å påvise disse bakteriene. For saltede produkter er det i tillegg mest interessant å måle nivået av bakterier som er salt-tolerante. Kimtallsmetoden er relativt arbeidskrevende og det tar flere døgn fra man tar prøven til man får svar. Metoden er altså ikke egnet dersom man ønsker å gi raske tilbakemeldinger på renhold.
-
ATP-metoden samsvarer bra med bakterietall, observasjoner og proteinmålinger. Metoden er sårbar for salt og derfor egner den seg ikke for prøvetaking av områder med høye saltkonsentrasjoner. Metoden er lite arbeidskrevende og gir raskt svar, men krever at man investerer i et spesialinstrument og kjøper inn analysesett fra leverandøren.
-
Visuell kontroll er en kvalitativ metode som er mindre sensitiv enn ATP og bakterietall. Metoden krever ikke noe utstyr, den dekker store områder og den er absolutt raskest.
-
Hurtigmetode for protein er lite følsom og i en del prøvepunkter fikk man ingen utslag på protein selv ved godt synlig belegg, høye ATP-verdier og høye bakterietall. Metoden krever at man kjøper inn analysesett fra en leverandør og den er mer tidkrevende enn ATP-metoden.
Hvilken metode man bør bruke avhenger altså av hvilken følsomhetsgrad man har behov for, og hvor viktig det er å få et raskt svar. For mange vil nok ATP kombinert med visuell kontroll være et godt alternativ.
Kartlagt bakterier i hvitfiskproduksjon
Før denne studien ble satt i gang visste man lite om hvilke bakterier om finnes i produksjonsmiljøet. Det var derfor vanskelig å si om renholdet burde forbedres eller var godt nok for en optimal kvalitet og holdbarhet. Vi fant et stort mangfold av marine bakterier på produksjonsutstyr i to fiskemottak. Flere er kjente holdbarhetsreduserende bakterier, og det ble konkludert med at et bedre renhold vil kunne gi en bedre og mer forutsigbar mikrobiologisk kvalitet. ATP-metoden ble funnet å kunne være en god metode for rask oppfølging av renhold.
Flere studier er nødvendig for å finne gode helhetlige løsninger som tar vare på kvaliteten til fisk. Det er viktig å finne den rette balansen mellom ulike forhold som påvirker holdbarhet. Det gjelder forhold som har betydning for bakteriesmitte (renhold) og bakterievekst (kjølekjede, emballering) gjennom hele kjeden fra fiskebåt til forbruker.
Slik målte vi hygienen
-
KIMTALL: Bakterieprøver ble samlet med sterile kompresser. Bakterietall ble målt ved standard mikrobiologisk analyse. Det ble tatt en svaberprøve med steril kompress (ca 5X5 cm). Bakteriene ble suspendert i fysiologisk saltvann, spredt på jernagar og PCA med 6% salt. Skålene ble inkubert ved 15oC.
-
ATP: ATP ble målt med svabring av 5X5 cm og et instrument for dette formålet (Clean-TraceTM) i henhold til instruksjoner fra leverandør.
-
PROTEIN: Protein ble målt med et kommersielt kit (Pro-clean) i henhold til instruksjoner fra leverandør.
-
VISUELL METODE: Synlig smuss og fuktighet i hvert punkt ble notert
-
BAKTERIESAMFUNNSANALYSE: Bakteriesamfunnsanalyse ble utført ved sekvensering av prøven (bakteriene spinnes ned, DNA isoleres og sekvenseres med MiSeq). Med denne metoden kan man identifisere bakteriesammensetningen til slektsnivå eller artsnivå avhengig av tilgjengelig informasjon i databaser og diversitet innen bakteriegrupper.
Referanser
1. Gram L, Huss HH. 1996. Microbiological spoilage of fish and fish products. International Journal of Food Microbiology 33:121-137.
2. Hansen AA, Moen B, Rodbotten M, Berget I, Pettersen MK. 2016. Effect of vacuum or modified atmosphere packaging (MAP) in combination with a CO2 emitter on quality parameters of cod loins (Gadus morhua). Food Packaging and Shelf Life 9:29-37.
3. Hansen AA, Rodbotten M, Lea P, Rotabakk BT, Birkeland S, Pettersen MK. 2015. Effect of Transport Packaging and Repackaging into Modified Atmosphere on Shelf Life and Quality of Thawed Atlantic Cod Loins. Packaging Technology and Science 28:925-938.
4. Bjorkevoll I, Olsen RL, Skjerdal OT. 2003. Origin and spoilage potential of the microbiota dominating genus Psychrobacter in sterile rehydrated salt-cured and dried salt-cured cod (Gadus morhua). International Journal of Food Microbiology 84:175-187.
5. Dang HY, Lovell CR. 2016. Microbial Surface Colonization and Biofilm Development in Marine Environments. Microbiology and Molecular Biology Reviews 80:91-138.
6. Ringo E, Sperstad S, Myklebust R, Refstie S, Krogdahl A. 2006. Characterisation of the microbiota associated with intestine of Atlantic cod (Gadus morhua L.) - The effect of fish meal, standard soybean meal and a bioprocessed soybean meal. Aquaculture 261:829-841.
7. Elifantz H, Horn G, Ayon M, Cohen Y, Minz D. 2013. Rhodobacteraceae are the key members of the microbial community of the initial biofilm formed in Eastern Mediterranean coastal seawater. Fems Microbiology Ecology 85:348-357.
8. Langsrud S, Moen B, Moretro T, Loype M, Heir E. 2016. Microbial dynamics in mixed culture biofilms of bacteria surviving sanitation of conveyor belts in salmon-processing plants. Journal of Applied Microbiology 120:366-378.
9. Møretrø T, Moen B, Heir E, Hansen AA, Langsrud S. 2016. Contamination of salmon fillets and processing plants with spoilage bacteria. International Journal of Food Microbiology 237:98-108.